En bref ...
La cellule est l'unité élémentaire de chaque être vivant. Elles renferment des organites, structures nanoscopiques accomplissant chacun leur rôle propre en son sein (production d'énergie. production ou dégradation de produits...).
Chez les plantes, elles présentent des caractéristiques les différenciant nettement de celles rencontrées chez les animaux. Ces différences reflètent, pour un certain nombre d'entre elles, les divergences observées entre les deux règnes : absence de mobilité propre, autotrophie, etc.
Les particularités essentielles des cellules végétales sont donc :
- la présence d'une double paroi cellulosique, voisine de celle rencontrée chez certaines bactéries, mais de structure différente, alors que les cellules animales sont nues,
- l'existence de chloroplastes, organites dédiés à la photosynthèse,
- le volume très réduit du cytoplasme, milieu intra-cellulaire, au profit d'un organite volumineux, la vacuole.
Introduction
C'est Schleiden et Schwann qui, en 1839, ont proposé les premiers de considérer chaque être vivant comme étant "constitué d'un assemblage d'unités morphologiques et physiologiques appelées cellules, issues les unes des autres par division". Chatton, en 1920, distingua les cellules procaryotes des cellules eucaryotes, munies d'un noyau renfermant le patrimoine génétique. Depuis, on a aussi différencié les cellules revêtues, apparues les premières, rencontrées chez les végétaux et les bactéries, et les cellules nue, répandues dans le règne animal.
La cellule végétale est eucaryote et de type revêtue.
Description générale
Les cellules végétales sont généralement de plus grande taille que les cellules animales. Une cellule de parenchyme palissadique, tissus assimilateur interne, d'une feuille d'épinard est de forme prismatique et mesure 60 microns de haut et 20 microns de large.
Une cellule végétale banale est enfermée à l'intérieur d'une
paroi rigide de 0,1 micron d'épaisseur. Cette paroi riche en polysaccharides est un cytosquelette extracellulaire dont les constituants sont synthétisés par la cellule elle-même. Elle est formée de fibrilles de cellulose disposées parallèlement à la surface cellulaire et dont les diamètres sont compris entre 3,5 et 10 microns. Ces fibrilles sont enrobées dans une matrice formée d'hémicellulose et de dérivés glucidiques, les pectines.
La cellule est limitée par une membrane plasmique plaquée contre la face interne de la paroi.
Toute la partie centrale du cytoplasme est occupée par un lysosome volumineux et très hydraté qui est la
vacuole.
Les autres organites cellulaires, communs avec ceux existant chez la cellule animale, sont situés en périphérie, entre la membrane de la vacuole appelée tonoplaste et la membrane plasmique : réticulum endoplasmique rugueux et lisse, ribosomes libres ou attachés aux membranes du réticulum, dictyosomes de l'appareil de Golgi, mitochondries, peroxysomes, noyau avec son enveloppe nucléaire et contenant de la chromatine ainsi que un ou deux nucléoles.
Seuls, les
chloroplastes, renfermant de la chlorophylles et dont la fonction est la photosynthèse, sont spécifiques aux végétaux. Responsables de l'autotrophie végétale, ils ne sont toutefois pas obligatoires chez les plantes : ils sont absents de tout (végétaux parasites) ou partie (tissus morts, bois, autres tissus non chlorophylliens) de l'organisme végétal. De même, les cellules juvéniles (ovules, embryons), font appel dans un premier temps à l'hétérotrophie et à la respiration mitochondriale pour se développer
Le cytosquelette intracellulaire comprend des microtubules et des filaments d'actine localisés principalement sous la surface cellulaire.
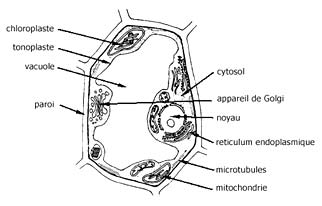 Fig. 1 : représentation schématique d'une cellule végétale
Fig. 1 : représentation schématique d'une cellule végétale
Enfin, contrairement à la plupart des cellules animales, les cellules végétales ne possède pas de centrioles. Elles sont aussi dépourvues de cils ou de flagelles, souvent présents dans la cellule animale. Cette absence, combinée à la présence de la paroi rigide, met en évidence l'absence de mobilité propre des végétaux.
Les cellules de certains tissus communiquent entre elles par des ponts cytoplasmiques qui traversent leur paroi : les plasmodesmes au nombre de plusieurs milliers par cellule. Certains plasmodesmes renferment un tube de réticulum endoplasmique lisse qui passe d'une cellule à sa voisine.
La paroi cellulaire
La présence d'une couche de substance inerte et rigide autour de chacune de leurs cellules est caractéristique des végétaux. En anglais, le terme de "cell-wall" est fréquemment usité.
Grâce à cette enveloppe très résistante, les cellules végétales échappent au danger de lyse en milieu hypotonique, danger contre lequel doivent lutter les cellules dépourvues de protection péricellulaire. L'hypotonie du milieu devient ainsi un facteur favorable à la nutrition, car la cellule relativement riche en substances dissoutes par rapport au milieu, tend à absorber de l'eau. Cette eau renferme des nutriments divers, mais seules les substances dissoutes ayant des molécules de faible dimension peuvent franchir la paroi. La paroi cellulaire végétale impose l'osmotrophie comme mode d'alimentation.
À cause de la rigidité de la paroi, ce sont seulement les cellules jeunes, à paroi en cours d'élaboration, qui peuvent s'allonger (auxesis) ou se subdiviser par bipartition (meresis). Dans le cas des cellules plus âgées, une dédifférenciation préalable de la paroi, au moins locale, est nécessaire.
Structure
La paroi des procaryotes (Archeobactéries, Bactéries et Cyanophycées) contient un maillage moléculaire à base de peptidoglycanes. Les végétaux eucaryotes sont quant à eux pourvus d'une paroi pectocellulosique.
Cette dernière est progressivement déposée, par couches successives, autour de la cellule, qui est donc peu à peu revêtue par des strates moléculaires principalement constituées de cellulose s'agençant en microfibrilles.
La densité des constituants et leur nature se modifient progressivement. Une cloison est édifiée entre deux cellules qui viennent de se former à partir d'une cellule mère. Cette cloison, appelée phragmoplaste, provient de la coalescence de vésicules formées par le cytoplasme commun aux deux cellules filles.
Relativement souple, riche en composés pectiques, elle deviendra la lamelle moyenne qui persistera entre les deux cellules contiguës. Sa gélification peut se produire dans diverses circonstances, amenant une séparation discrète, avec formation de méats remplis de liquide ou de gaz, ou complète des cellules voisines, alors dissociées.
De part et d'autre de la lamelle moyenne, la paroi proprement dite est produite par les cellules contiguës, par excrétion de cellulose au niveau des dictyosomes de leur cytoplasme. Les couches successives ainsi constituées à la périphérie de chaque cellule sont donc d'autant plus jeunes qu'elles sont plus internes. Le durcissement des couches externes entraîne une solidité qui confère à la paroi une fonction de soutien dans les tissus végétaux.
Constitution
La paroi pectocellulosique des cellules végétales est constituée d'une phase fibreuse cellulosique et d'une phase amorphe. La phase amorphe est un mélange d'hémicellulose et de pectines. Malgré sa rigidité, la paroi cellulosique est très hydratée, puisqu'elle contient de 70% à 95% d'eau.
La
cellulose, molécule la plus représentée sur terre, est un polymère de glucose. Sa synthèse réside en trois phases : photosynthèse de glucose, assemblage de cellobiose (dimères de glucose) dans le reticulum endoplasmique et polymérisation des cellobioses dans le plasmalemne. Une molécule de cellulose possède environ 10.000 résidus glucidiques. C'est une molécule polarisée : l'une de ses extrémités est réductrice. Elle est au centre d'un paradoxe : si sa synthèse est bien connue, on ne connaît pas d'enzymes capable de la dégrader, et pourtant, son taux de présence reste constant.
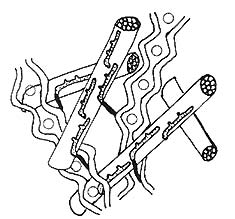 Fig. 2 : ultrastructure moléculaire de la paroi pecto-cellulosique
Fig. 2 : ultrastructure moléculaire de la paroi pecto-cellulosique
L'
hemicellulose est une chaîne polyglucidique ramifiée, capable de former des liaisons hydrogènes avec la cellulose. Elles servent donc en partie à feutrer les filaments de cellulose.
Les
pectines sont des polymères d'acides uroniques (hexoses pourvues d'un radical carboxylique) ramifiées. Des rhamnoses (pentoses) peuvent s'y intégrer à des intervalles réguliers, formant une série de coudes. L'association de deux chaînes de pectines coudées emprisonne des ions Ca
2+, constituant ainsi une structure alvéolaire. Enfin, elles sont très hydrophiles.
Enfin, on trouve quelques
éléments protéiques, le plus fréquent étant l'extensine. Ces éléments appartiennent à la famille des HRGP (hydroxyn rich glyco protein), et représentent de 0,1 à 15% de la masse sèche des parois. Leur composition chimique est proche du collagène animal.
Croissance et évolution
La mise en place de la paroi débute par l'arrimage de la cellulose synthétase à la membrane plasmique de la cellule. Elle oriente sa synthèse et donc les filaments de cellulose. L'hemicellulose, les pectines et l'extensine sont exportées ultérieurement. La cellule, lors de son état prématuré, synthétise une paroi primaire, puis une paroi secondaire à son état mature.
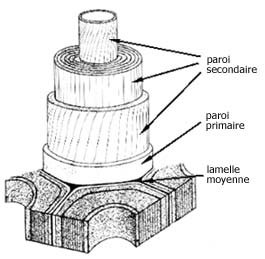 Fig. 3 : structure de la paroi cellulaire
Fig. 3 : structure de la paroi cellulaire
Les fibres de cellulose forment des liaison hydrogène avec les hémicelluloses, reliées aux pectines par des ramifications d'arabidanes. Il se forme un filet moléculaire dans les mailles duquel circulent eau et solutés. Ce modèle a été elaboré par Albersheim, McNeil et labavitch en 1977.
A chaque phase de croissance, il y a un décalage entre l'orientation de chaque couche de fibres, donnant une structure globale en contre-plaqué. Le cytosquelette contrôlerait cette disposition complexe : la cellulose synthétase est associée à une protéine d'ancrage liée à des éléments du cytosquelette.
D'autres éléments interviennent pour la rigidifier ou l'imperméabiliser : la lignine, la cutine formant une croûte externe, le cuticule, des cires, de la subérine.
Lorsqu'elle est en croissance, la cellule végétale devient turgescente, et exerce une pression sur ses parois. Elle parvient à les assouplir grâce notamment à l'extensine qui, une fois dénaturée, fait perdre de la cohérence à l'ensemble, avant de redevenir active en regagnant sa conformation originale et de redonner de la rigidité à la paroi.
Rôles
En 1985, Albersheiom et Darvill ennonçaient que "l'étonnante complexité des composants a fait comprendre que leur rôle n'était peut être pas seulement structurel". Les rôles de la paroi sont donc assez variés, et tendent à pallier en partie à certains inconvénients des organismes végétaux :
- - maintient de la forme cellulaire ;
- - maintient de la tension osmotique par rapport au milieu extérieur;
- - croissance : une molécule complexe, glucidique (XG9 ), se trouve autour de la paroi. C'est en fait un fragment d'hemicellulose mobile. Elle a un effet antagoniste sur l'auxine (hormone végétale). La croissance des plantes est donc fonction des fluctuations des taux d'auxine et de XG9 ;
- - défense : de nature physique ou chimique, grâce à un autre fragment d'hemicellulose stimulant l'expression d'un gène codant pour une enzyme luttant contre les champignons unicellulaires.
La vacuole
La cellule végétale typique renferme une grande vacuole centrale, ou vacuome : son cytoplasme est creusé d'une vaste dépression remplie du liquide vacuolaire, et bordée par une membrane, le tonoplaste, mise en évidence par De Vries en 1885. Cette dépression atteins dans certains cas 95% du volume cellulaire. Le terme de vacuole dérive du latin vacuus (vide) : on croyait jadis que cette cavité ne servait à presque rien, au mieux de déversoir pour les déchets métaboliques.
Certains colorants envahissent la vacuole sans déborder du tonoplaste lorsque la cellule est vivante ; en cas de mort cellulaire, ils envahissent tout le cytoplasme. Au microscope électronique, la vacuole apparaît comme une zone plus claire que le cytoplasme environnant.
Le tonoplaste présente, à fort grossissement, l'image trilamellaire classique valable pour toutes les membranes cellulaires. Il assure notamment le tri et le transport des solutés entrant ou sortant de la vacuole.
Origine
Le problème de l'origine de la vacuole s'est éclairci à la suite de son rattachement au système lysosomal. On savait depuis longtemps qu'elle dérivait de la confluence d'un grand nombre de petites vacuoles présentes dans la cellule méristématique. On sait aujourd'hui que ces protovacuoles sont de véritables lysosomes secondaires, souvent anastomosés en réseau dans la cellule juvénile.
Les hydrolases actives que renferment ces organites se livrent à une véritable autodigestion de portions de cytoplasme. Après cette véritable autophagie ou métamorphose cellulaire, des protovacuoles se creusent à la place des territoires éliminés, puis finalement confluent en une grande vacuole centrale.
Contenu vacuolaire
Riche en composés métaboliques, le suc vacuolaire présente des variations selon l'espèce considérée, le milieu environnant et l'âge de la cellule. Si certaines molécules ne font qu'un transit dans la vacuole, d'autres s'y accumulent.
Des vacuoles ont pu être isolées récemment de cellules végétales adultes. Les activités enzymatiques associées à ces fractions vacuolaires isolées sont essentiellement des activités hydrolytiques : protéinases, exopeptidases, RNAses, DNAses, phosphatases, phosphodiesterases, acétylesterases, amylases, glucosidases, galactosidases, mannosidases, etc. Ces caractéristiques enzymatiques rattachent nettement les vacuoles végétales aux lysosomes des cellules animales.
On y distingue des éléments du métabolisme primaire (éléments intermédiaires) et des éléments du métabolisme secondaire (éléments finaux). Certains jouent un rôle très important pour la vie cellulaire.
Parmi les
métabolites primaires, on distingue :
- - des acides carboxyliques, éléments apparaissant au cours du cycle de Krebs. Par exemple, l'acide malique est un régulateur important du pH cellulaire : une alcalinisation du milieu cellulaire induit sa synthèse. L'acide oxalique, toxique pour la cellule, est évacué dans la vacuole, où il se cristallise sous forme de macles, d'aiguilles, de prismes...
- - des glucides, éléments de réserve nutritive. Si l'amidon est stocké au niveau des amyloplastes, on y trouve du saccharose, et d'autres glucides dont la répartition dépend de la position systématique du végétal (inuline des Asteraceae, Liliaceae et Campanulaceae, salep des Orchidaceae, stachyose de certaines Lamiaceae, etc.)
- - des acides aminés, plus rares, qui semblent participer à la régulation de la synthèse des proteines par retro inhibition.
Les
métabolites secondaires, de structure plus complexes (flavonoides, tanins, alcaloides...), ont un rôle partiellement connu, mais on sait que nombreux sont ceux intervenant dans les relations entre le végétal et son milieu. Par exemple, la coumarine est un composé phénolique toxique pour les êtres vivants. Sa synthèse necessite deux précurseurs distincts : l'un se trouve dans la vacuole, l'autre dans le cytoplasme. La désorganisation cellulaire suivant l'ingestion du végétal par un animal, par exemple, provoque la mise en contact et la synthèse de la coumarine. Cette molécule a donc un rôle de défense de la plante. Chez d'autres végétaux, un processus similaire aboutit à la synthèse d'acide cyanhydrique, proche du cyanure.
Les aleurones
Au moment de la formation des graines, les vacuoles des cellules concernées se déshydratent fortement et se transforment en grains d'aleurones, organites de réserve souvent riches en protides. Les aleurones homogènes ne renferment que des protéines alors que les aleurones hétérogènes renferment en plus de la phitine et du carbonate de calcium.
Lors de la germination, l'aleurone se réhydrate et repasse à l'état vacuolaire. Les données concernant ces mécanismes sont encore presque entièrement inexistantes.
De même, les sphérosomes ou gouttelettes lipidiques de réserve dans les graines oléagineuses se rattachent au système vacuolaire par les hydrolases qui s'y accumulent au moment de la germination.
Vacuole et osmose
Le premier rôle dévolu à la vacuole était le
maintien de la turgescence cellulaire. En conditions naturelles, le suc vacuolaire est hypertonique par rapport au milieu exterieur.
La pression osmotique du liquide vacuolaire, combinée à la contre-pression pariétale exercée sur la cellule par les parois du cadre pectocellulosique, détermine les mouvements d'eau entre le milieu et la cellule végétale.
On appelle potentiel hydrique (Q) de la cellule, la différence entre la contre-pression (P) due à la déformation élastique des parois et la pression osmotique (p) de la vacuole : Q (exprimée en bars) = -p + P
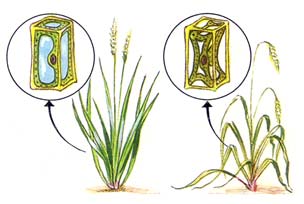 Fig. 4 : les phénomènes de turgescence (gauche) et de plasmolyse (droite) expliquant le port érigé ou fané de la plante
Fig. 4 : les phénomènes de turgescence (gauche) et de plasmolyse (droite) expliquant le port érigé ou fané de la plante
Q est habituellement de l'ordre de -10 à -15 bars dans de nombreux tissus végétaux. L'eau migre toujours des milieux de potentiels hydriques élevés vers les milieux de plus bas potentiels. Lorsque l'eau pénètre dans une cellule végétale et gonfle la vacuole (endosmose), la cellule entre en turgescence : cet état des cellules provoque le port dressé des végétaux non ligneux. Au contraire, lorsque de l'eau quitte la vacuole vers un milieu extérieur de plus bas potentiel hydrique (exosmose ou transpiration), la cellule perd sa turgescence puis entre en plasmolyse. Il s'ensuit un état de flétrissement des tissus qui ne doit pas être poussé trop loin sous peine de devenir irréversible (fanaison).
Turgescence
L'origine de la turgescence se trouve dans les corps dissous principalement dans l'eau de la vacuole, ces molécules dissoutes exerçant une attraction sur les molécules d'eau situées à l'extérieur de la cellule, pourvu que la pression osmotique vacuolaire soit plus élevée que celle de la solution extérieure.
Quand une trop forte quantité d'eau part des cellules d'une plante vers l'atmosphère, la turgescence cesse, la plante s'affaisse plus ou moins, c'est le phénomène du flétrissement, ou de la fanaison, réversible d'abord par déplacement de la plante en atmosphère humide ou dans l'eau, puis irréversible et entraînant la mort cellulaire. La pression de turgescence est donc à l'origine du maintien des végétaux herbacés, peu munis en tissus de soutien, ainsi que du maintien des parties jeunes des plantes ligneuses, jeunes rameaux et feuilles des arbres, non lignifiées.
De plus, des variations de turgescence de cellules très localisées de nombreuses plantes produisent chez elles des mouvements d'organes, tels que les fermetures de pétales de fleurs ou de folioles, ou les mouvements d'étamines, ou encore le reploiement des tentacules-pièges de feuilles de plantes carnivores. Ces variations de turgescences représentent le seul moyen qu'ont les végétaux d'avoir parfois des mouvements propres.
La turgescence intervient aussi dans les mécanismes complexes d'ouverture et de fermeture des stomates, qui règlent l'intensité de la transpiration de la plante et peuvent, entre autres effets, s'opposer à un trop sensible déficit en eau dans ses tissus. Enfin, dans les organes en croissance, la turgescence des cellules est en partie responsable de la croissance par allongement.
Epictèse
Propriété des cellules végétales de pratiquer une absorption supplémentaire de sels minéraux pour maintenir leur pression osmotique interne légèrement supérieure à celle du milieu, l'épictèse (du grec : ktésis , acquisition, épi, en supplément) fut découverte par le physiologiste français Lapicque en 1925 sur l'algue brune Ectocarpus.
Comme il est de règle chez les végétaux, les vacuoles ont une pression osmotique légèrement supérieure à celle du milieu. Cette hypertonie entraîne une certaine suppression du suc vacuolaire qui distend les parois lors de la turgescence.
Lapicque déposa un fragment d'Ectocarpus dans de l'eau de mer. Au niveau cellulaire, une légère turgescence se manifeste par une convexité des parois transversales. Il ajouta alors du saccharose au milieu : comme prévu, l'eau sortit des vacuoles et les membranes s'infléchirent vers l'intérieur, inflexion qui précède la plasmolyse proprement dite. Mais après quelques heures, la plasmolyse régressa et la turgescence repris le dessus.
Il y a donc une rentrée d'eau, qui ne peut s'expliquer que par une élévation de la pression osmotique vacuolaire, ce qu'a vérifié Lapicque. Or le saccharose pénétrant très mal dans les cellules végétales et l'Ectocarpus ne possédant pas de réserves hydrolysables, cette élévation ne peut être due qu'à une entrée de sels minéraux venus de l'eau de mer. L'addition de saccharose n'ayant en rien modifié les conditions physico-chimiques présidant aux transports passifs, Lapicque conclut que ce supplément d'absorption saline était dû à un processus physiologique faisant appel à l'énergie métabolique. C'était là la première mise en évidence d'un transport actif réalisé contre un gradient électrochimique.
L'épictèse permet donc à une cellule d'ajuster sa pression osmotique interne à la pression osmotique externe, lorsque celle-ci varie.
Le phénomène se retrouve sur les racines des végétaux supérieurs, qui, dans certaines limites, peuvent élever leur pression osmotique interne alors que celle du sol s'élève (dessèchement, salure). Les halophytes, qui vivent en terrain salé, ont un très fort pouvoir d'épictèse qui leur permet, en surconcentrant leur suc vacuolaire, de maintenir l'hypertonie nécessaire à leur alimentation hydrique, malgré la forte pression osmotique externe, atteignant plusieurs dizaines de bars.
L'épictèse, comme tout transport actif, est réalisée grâce à des pompes ioniques situées sur les membranes. Le mécanisme par lequel elles reçoivent le signal extérieur n'est pas connu.
Les plastes
Les plastes sont des organites propres aux cellules des végétaux chlorophylliens. Les chlorophylles, pigments de la photosynthèse, se trouvent exclusivement dans les plastes et sont généralement associées à des quantités variables de pigments caroténoïdes. L'ensemble des plastes est parfois dénommé plastidome.
D'après leur teneur en ces divers pigments, on distingue trois catégories de plastes :
- - les chloroplastes, dont les pigments essentiels sont les chlorophylles ;
- - les chromoplastes, où dominent les pigments caroténoïdes, souvent au point de ne plus renfermer de chlorophylles ;
- - les leucoplastes dépourvus de pigments, comprennant les amyloplastes et les étioplastes.
Toutes ces structures sont organisées de la meme manière que les chloroplastes. Ils naissent tous de précurseurs, les proplastes des cellules embryonnaires.
Les leucoplastes
Les leucoplastes se trouvent principalement dans les tissus des végétaux chlorophylliens qui ne sont pas atteints par la lumière. Toutefois, de nombreux épidermes ne renferment que des leucoplastes. Ce sont des organites cytoplasmiques sans pigments, légèrement plus réfringents que le cytoplasme dont ils suivent les mouvements en se déformant constamment. Leur aspect rappelle, en plus grand, celui des mitochondries. Comme ces dernières, ils sont très fragiles et notamment très altérables par les fixateurs acides ou alcooliques. Ils n'ont pas de formes bien définies.
Àl'aide de la microscopie électronique, on les voit limités par deux membranes, comme les chloroplastes. La membrane interne émet dans le stroma des crêtes analogues à celles des mitochondries. Le stroma renferme généralement des globules lipidiques.
On peut y associer les amyloplastes, forme la plus courante de mise en réserve de l'amidon, et les étioplastes, structures désorganisées apparaissant lorsque le végétal est durablement privé de lumière.
Les chromoplastes
Les chromoplastes sont caractérisés par leur richesse en pigments caroténoïdes (carotènes, xanthophylles...) qui peuvent subsister seuls ou masquer les chlorophylles. On les trouve surtout dans les pièces florales colorées en rouge clair ou en jaune, dans les fruits de ces mêmes couleurs, mais aussi dans certaines tiges, feuilles et même racines (carotte). Ils ont été longuement étudiés sur le vivant, notamment par A. Guilliermond qui en a distingué plusieurs catégories d'après l'état physique des pigments : diffus ou dissous dans des gouttelettes lipidiques (pétales de tulipe, baies d'asperge), cristallisés (carotte, tomate), fixés sur des structures fibrillaires (piment).
La différenciation des chromoplastes est en général accompagnée du vieillissement de l'ensemble de la cellule. Les plastes eux-mêmes présentent des signes de dégénérescence. Cette évolution est précédée ordinairement d'une phase d'amylogenèse intense, puis l'amidon est hydrolysé et les pigments s'accumulent. Cette différenciation est, sauf exceptions très rares, irréversible.
La différenciation des plastes
Les chromoplastes résultent habituellement de la différenciation secondaire de chloroplastes ou de leucoplastes, alors que les chloroplastes et les leucoplastes proviennent typiquement de l'évolution directe de précurseurs présents dans les cellules méristèmatiques, appelés proplastes. Ces derniers ont des dimensions, une infrastructure et des propriétés très voisines de celles des mitochondries. Ils présentent la même fragilité et s'altèrent de la même manière par cavulation. Ils sont limités par deux membranes dont l'interne émet des crêtes dans le stroma.
La différenciation en leucoplastes est relativement simple : le plaste s'accroît, ce qui le distingue de mieux en mieux des mitochondries. Le stroma acquiert des globules lipidiques, très souvent des grains d'amidon, et les crêtes grandissent plus qu'elles ne se multiplient, contrairement à celles des mitochondries.
La différenciation en chloroplastes est plus complexe et a suscité de nombreux travaux. En fait, le problème important n'est pas résolu : il s'agit du mécanisme de croissance des membranes qui formeront les thylacoïdes. Il est certain que, du moins au début, la membrane interne forme des crêtes qui s'allongent considérablement puis constituent les premiers thylacoïdes. Cette même activité de la membrane interne peut aussi se traduire par une profusion de petites vésicules au lieu de crêtes. Ces vésicules s'assemblent fréquemment en une masse, parfois visible sur le vivant, successivement appelée centre plastida, granum primaire ou corps prolamellaire.
On peut voir, au microscope électronique, que, lorsque les structures des chloroplastes s'édifient normalement, ces vésicules confluent en thylacoïdes et le granum disparaît. On a cru pendant un certain temps que ce granum était doué de continuité génétique et se trouvait toujours dans les proplastes. On sait aujourd'hui que quelques espèces végétales en forment normalement, mais que, pour la plupart, le granum primaire n'apparaît que dans des conditions de déficience de lumière. On le trouve d'ailleurs régulièrement dans les plantes étiolées, et le reverdissement à la lumière le fait disparaître, tandis que les thylacoïdes s'édifient.
Lorsque la différenciation est assez avancée, les rapports entre les thylacoïdes et la membrane interne deviennent très difficiles à préciser. La croissance des thylacoïdes et leurs ramifications ne sont peut-être plus dépendantes de cette membrane interne. La différenciation des chloroplastes est assortie d'une croissance considérable de ces organites. Cependant, le stroma semble avoir de moins en moins d'importance volumétrique, tandis que le système lamellaire se développe.
Les chloroplastes
Les chloroplastes permettent aux végétaux chlorophylliens de capter l'énergie solaire et de la mettre en réserve sous forme d'adénosine-triphosphate (ATP), pourvoyeur de l'énergie chimique nécessaire aux biosynthèses et d'abord à la réduction du CO2.
Par cette puissance de synthèse due aux chloroplastes, les végétaux verts sont, avec certaines bactéries, les seuls êtres vivants capables d'entretenir, par apports nouveaux, la quantité de substances organiques de la biosphère dont les végétaux sans chlorophylle et tous les animaux sont tributaires.
La photosynthèse est le seul phénomène naturel producteur d'oxygène moléculaire. Il est probable que tout l'oxygène atmosphérique provient de la photosynthèse : c'est une autre raison de subordination de la vie animale au fonctionnement des végétaux autotrophes.
Localisation et morphologie
En général, les chloroplastes se trouvent dans des cellules ou des tissus exposés à la lumière, mais on connaît quelques exceptions.
Les chloroplastes des végétaux supérieurs ont le plus souvent une forme lenticulaire et leur plus grand diamètre est de l'ordre de 3 à 6 microns. Leur épaisseur est voisine de 2 microns. Les cellules chlorophylliennes en renferment un nombre apparemment indéterminé, parfois très élevé, comme dans les cellules palissadiques des feuilles.
Chaque chloroplaste est limité par une
double membrane, d'environ 6 à 8 nm d'épaisseur, concentriques et distantes d'environ 10 nm, délimitant un milieu intérieur, le
stroma. La membrane interne émet dans le stroma des replis en forme de crêtes, rappelant celles des mitochondries. Ces replis sont toutefois rares dans les chloroplastes entièrement différenciés.
Dans le stroma se trouvent surtout de nombreuses lamelles, partiellement associées en empilements compacts. Une analyse précise montre qu'il s'agit en réalité de saccules aplatis dont les profils sont plus ou moins longs et parfois discontinus. Ces saccules sont les
thylacoïdes, définis par Menke. Leur membrane a 7 nm d'épaisseur, et contient de la chlorophylle et d'autres pigments. Ils sont orientés parallèlement au grand axe du chloroplaste.
Certains thylacoides sont empilés : chaque pile est un
granum. On compte entre 40 et 60 granums par chloroplaste. Ils reliés entre eux par les thylacoïdes les plus étendus.
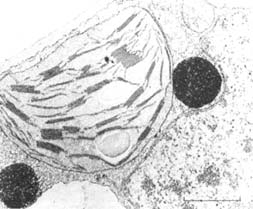
 Fig. 5 : ultrastructure du chloroplaste.
Fig. 5 : ultrastructure du chloroplaste.
A gauche, microphotographie d'ensemble ; à droite : en haut, représentation schématique et en bas, détails montrant les rapports des granas avec les membranes des thylacoïdes.
Les disques granaires résultent çà et là de replis partiels de thylacoïdes, de duplications marginales par invagination ou encore, ce n'est peut-être qu'un aspect du précédent mécanisme, de la bifurcation d'un thylacoïde intergranaire.
W. Wehrmeyer interprète les empilements granaires comme les résultats d'une sorte de bourgeonnement marginal de thylacoïdes préexistants, accompagné d'une croissance dissymétrique provoquant l'arrangement en piles des thylacoïdes successifs. On considère maintenant comme très probable le fait que les cavités internes des divers thylacoïdes sont toutes en continuité les unes par rapport aux autres grâce aux isthmes des bourgeons, aux replis ou aux bifurcations. Le chloroplaste se composerait donc d'un espace intrathylacoïdal (peut-être en continuité avec l'espace intermembranaire périphérique) et d'un espace extrathylacoïdal occupé par le stroma.
Appliquée aux chloroplastes, la technique d'imprégnation par l'iodure de zinc-tétroxyde d'osmium, qui permet, en créant des contrastes vigoureux et plus ou moins sélectifs, de préciser la topographie des divers compartiments cellulaires, appuie fortement l'idée d'un espace intrathylacoïdal continu (D. Marty, 1976).
Le stroma contient aussi des
molécules d'ADN circulaire de 50 microns de circonférence et qui sont au nombre d'une vingtaine par chloroplaste : ce sont les molécules d'ADN chloroplastique ou ADNct. De plus le stroma renferme des plastoribosomes différents de ceux du cytoplasme et des mitoribosomes. Les plastoribosomes synthétisent des chaînes polypeptidiques de la membrane des thylakoïdes et certaines enzymes du stroma. La cellule végétale possède donc deux types de structures extrachromosomiques porteuses d'information : les molécules d'ADNmt situées dans la matrice des mitochondries et les molécules d'ADNct situées dans le stroma des chloroplastes.
On y trouve aussi des globules lipidiques, ou plastoglobules, qui peuvent se charger de caroténoïdes dissous, et très souvent des grains d'amidon inclus dans une sorte d'enclave claire analogue à une vacuole, mais dépourvue de membrane limitante.
La structure ainsi décrite est habituelle chez les végétaux supérieurs, mais n'est pas générale. Il existe de rares tissus de ces plantes qui ont des chloroplastes sans grana et c'est surtout le cas de la plupart des Algues. En fait de structures lamellaires, les chloroplastes dits agranaires renferment à peu près exclusivement de grands thylacoïdes, dont les profils sont parfois plus longs que le diamètre du plaste, auquel cas ils en suivent plus ou moins le contour.
Les chloroplastes des Algues comportent par contre une structure qui ne se trouve pas chez les végétaux supérieurs : le pyrénoïde. C'est un granule protéique, plus dense que le stroma, qui peut être traversé par quelques thylacoïdes, dès lors modifiés et souvent tubulaires. C'est autour du pyrénoïde que la totalité ou la plupart des grains d'amidon sont concrétionnés.
Une autre particularité structurale se trouve liée aux plastes des cellules chlorophylliennes mobiles, qui nagent dans le milieu aquatique (certaines Algues unicellulaires, spores flagellées, gamètes). Le chloroplaste, s'il est unique, ou l'un des chloroplastes, s'ils sont multiples, porte une tache pigmentée, rouge intense, le stigma ou tache oculaire, qui détermine le phototactisme de ces cellules. Le stigma est constitué d'une ou de deux assises de granules lipidiques fortement chargés d'un pigment caroténoïde dissous. Ces granules, serrés côte à côte, forment une aire restreinte, située immédiatement au-dessous des deux membranes limitantes du plaste. Lorsqu'il existe deux ou plusieurs assises, elles sont généralement séparées par un thylacoïde. Un autre thylacoïde longe la face interne du stigma.
Constitution chimique générale
Depuis de nombreuses années, on sait extraire les chloroplastes des tissus végétaux et on a réalisé à maintes reprises l'analyse qualitative et quantitative de tels organites. En dehors de l'eau, trois groupes de substances dominent quantitativement dans les chloroplastes : les protéines, les lipides et les chlorophylles. Les chloroplastes sont en outre riches en substances minérales.
Parmi les divers types de chlorophylles, une seule est présente chez tous les Végétaux chlorophylliens, la chlorophylle a. La chlorophylle b se trouve dans les plastes des végétaux vasculaires, des Bryophytes et des Algues vertes. D'autres Algues possèdent aussi des chlorophylles c, d et e. Les chloroplastes des végétaux supérieurs renferment en outre des pigments caroténoïdes dont le b-carotène et plusieurs de ses dérivés oxydrilés, xanthophylles notamment, sont les plus répandus.
Les analyses de chloroplastes isolés, décèlent en outre de nombreux constituants, dont l'étude physiologique a révélé l'importance. Ce sont d'abord des transporteurs constituant la chaîne photosynthétique. Il faut encore ajouter les accepteurs d'électrons et de protons, comme le NADP, ainsi que l'ADP et l'ATP qui interviennent dans la photophosphorylation et le stockage de l'énergie lumineuse sous forme d'énergie chimique. Enfin, les chloroplastes renferment des l'acides nucléiques ADN et ARN.
Composition du stroma
Le gel stromatique fondamental renferme de nombreuses protéines, surtout de multiples enzymes, qui interviennent dans les réactions obscures de la photosynthèse, et diverses molécules organiques qui résultent de ces réactions : glucides solubles, acides organiques, acides aminés, nucléotides, etc., auxquels s'ajoutent des ions phosphate, inorganiques ou organiques (ADP, ATP).
En outre, des constituants figurés, au moins à l'échelle de la microscopie électronique, sont noyés dans le fond stromatique. C'est le cas de l'ADN chloroplastique, constitué de molécules circulaires bicaténaires, à l'état non combiné et au nombre de 10 à 30 copies par chloroplaste. Cet ADN s'observe dans des éclaircies du stroma. Il code pour divers ARN, donc pour certaines protéines chloroplastiques. Une partie de ces ARN contribue à l'édification de plastoribosomes analogues à ceux des Procaryotes, disséminés dans le stroma ou appliqués contre les membranes.
La découverte de l'ADN chloroplastique (Ris et Plaut, 1962) soulève la question du degré d'autonomie des plastes dans les cellules végétales. Elle a remis en vogue la notion de plastome opposé au génome. On peut dire que les plastes possèdent bien une sorte d'autonomie dans certaines de leurs biosynthèses, mais que le développement des chloroplastes demeure largement sous le contrôle du noyau. Ainsi, les déterminants de la synthèse de chlorophylle a et, par voie de conséquence, de la construction des grana, sont des gènes nucléaires (D. von Wettstein).
L'ADN chloroplastique se comporte cytologiquement comme l'ADN bactérien ou celui des Cyanophyceae. De même que l'ADN mitochondrial a remis en mémoire l'idée des symbiotes (P. Portier), l'ADN plastidal confère aux chloroplastes de frappantes ressemblances avec les Cyanophyceae, dont le chromatoplasma rappelle le stroma plastidal avec ses lamelles chlorophylliennes. Aussi, l'idée d'une origine protocaryotique des chloroplastes a été envisagée, évoquant l'acquisition par des Cyanophytes autotrophes, qui étaient initialement libres, d'un parasitisme d'Eucaryotes ancestrales, devenu obligatoire.
Les réseaux apoplastiques et symplastiques
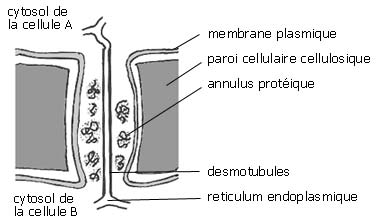 Fig. 6 : structure d'un plasmodesme
Fig. 6 : structure d'un plasmodesme
Les parois constituent un réseau continu, l'
apoplasme, où des éléments solubles peuvent migrer plus ou moins librement.
Contrairement aux cellules animales, les relations entre les différentes cellules d'un végétal ne sont pas représentées par des jonctions intercellulaires, mais par les
plasmodesmes dont la cellule contrôle l'ouverture. Ce sont de petits canalicules unissant les cytoplasmes et membrane plasmique de deux cellules adjacentes. Une cellules comporte de deux à trois mille plasmodesmes : ceux ci permettent de mettre en communication toutes les cellules d'un organisme végétal.
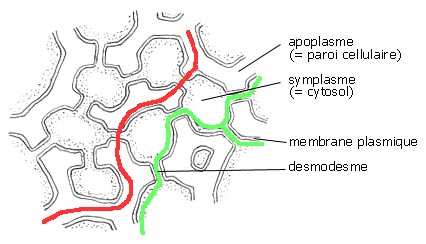 Fig. 6 : Les voies apoplasmiques (rouge) et symplasmiques (vert) de la circulation de l'eau dans un tissu végétal.
Fig. 6 : Les voies apoplasmiques (rouge) et symplasmiques (vert) de la circulation de l'eau dans un tissu végétal.
L'ensemble des plasmodesmes constitue le
synplasme.
Les voies
apoplasmiques et
symplasmiques constituent les deux voies de cheminement des métabolites chez les organismes végétaux.
Ces deux voies sont indépendantes et ne viennent jamais au contact l'une de l'autre, elles sont toujours séparées par la membrane plasmique.
La division de la cellule végétale
Comme chez les cellules animales, la cellule végétale dispose de deux moyens de se diviser : la mitose, simple dédoublement de la cellule mère en deux cellules filles, sans modifications du patrimoine génétique, et la méiose, plus complexe, faisant intervenir un brassage génétique, et aboutissant à la formation de cellules germinales haploides à partir d'une cellule mère diploide.
Mitose
Si, dans les grandes lignes, la division de la cellules végétale présente les mêmes processus que celle décrite chez l'animal, deux caractéristiques fondamentales l'en distinguent : la présence de la paroi pectocellulosique rigide et l'absence de centriole. Si la cytodiérèse (duplication du noyau) est quasiment identique chez la cellule végétale et chez la cellule animale, la cytokinèse (séparation des deux cellules filles) présente quelques particularismes.
Juste avant la division, pendant un court laps de temps, les microtubules cytosquelettiques qui sont à l'interphase repartis régulièrement à la périphérie de la cellule, se concentrent selon l'un de ses diamètres y constituant une bande préprophasique.
C'est à la fin de la télophase que le cytoplasme de la cellule mère commence à élaborer une nouvelle paroi pectocellulosique afin de séparer les deux cellules filles. Ce phénomène, observé depuis longtemps, comporte plusieurs étapes :
Méiose
Sa seule originalité, par rapport à la méiose animale, réside dans la formation éventuelle de tétrades, groupes de quatre cellules germinales réunies dans un premier temps dans un cal commun. Leur séparation ultérieure donnera souvent des cellules morphologiquement identifiables grâce à leur aspect tétraédrique.